离子导体
包括电解质溶液或熔融电解质,注意随温度升高,溶液黏度下降,离子运动速度加快,导电性上升。
可逆电池
可逆电池有两个要求:
- 电极上的化学反应可向正、反两个方向进行
- 可逆电池工作时(无论方向)所通过的电流必须十分微小
书写方法
- 左负右正
- |表示相界面、||表示盐桥(忽略接界电势)
- 注明温度、压力、活度、物态
电极
阳极发生氧化(负极)、阴极发生还原(正极)。
可逆电极
- 金属-离子(-气体)电极,当存在气态物质时需要加入惰性导体作为电极
- 金属-难溶盐(覆盖于表面)电极
- 氧化-还原电极:两种金属离子,插入惰性导体(注意醌-氢醌电极)
电势
测定:对消法
原理——使用一个外加电源,连在一根电阻上,注意棒上两点的电势差与长度成正比:
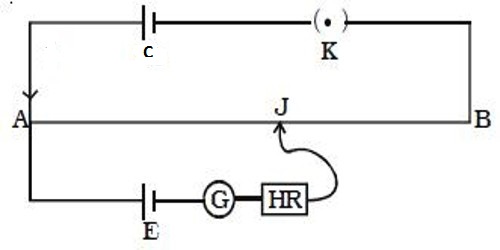
已知电势的电池和待测电池依次与外加电源并联,当电流计归零时可通过棒长得到电动势大小比值。
液接电势
液接电势主要由扩散作用(正负离子都要扩散,但速率不同,比如 $\ce{H+}$ 更快)引起(参考 PN 结),可通过盐桥消除(相当于速率相同)。
电极电势
一般规定标准氢电极的电极电势为0,放在电池负极,此时电池的电动势就是待测电极的电势。
电势的组合
只需注意在加减时注意:$v_\C E^\ominus(\C)$
Nerst 方程
$$ E=E^\ominus-\frac{RT}{zF}\ln Q $$
参比电极
$$\ce{AgCl(s) + e- -> Ag(s) + Cl-(aq)}\\\ce{Hg2Cl2(s) + 2e- -> 2Hg(s) + 2Cl-(aq)}$$
循环伏安法
加入惰性电解质(分析物浓度太低,加大电导率)。
电解
电解时的分解电压一般大于可逆电动势: $$ E_{分解}=E_{可逆}+\D E_{不可逆} + IR(热能) $$
极化
- 浓差极化——来不及扩散导致电极附近离子浓度小于溶液中的“平均浓度”(可逆电势照此计算)
- 电化学极化——多步电化学过程中某步骤具有较大的活化能
超电势的正负——无论在原电池还是在电解池中都是阻碍作用。
