引入
在研究主族元素化学时,等电子原理是非常好用的手段(如BN-C)等等,但等电子原理在处理副族时遇到了困难——副族金属倾向于18电子而非8电子。怎么办呢?一个巧妙的办法是作差——看还缺几个电子来达到满壳层。
已经满壳层(稀有气体或满足18电子)的物种十分稳定,不需多说。
缺一个电子满壳层(卤素和17电子物种)有不少相似之处:尤其是Co(CO)4。

缺两个电子:例:S和Fe(CO)4

当然,作差的类比也会遇到硬茬——不符合八隅律的超价化合物(IF7、XeF4还没找到金属有机类似物);对金属而言,当配体不如CO时,18电子规则可能就没有那么好用了,相似性也会大大减小。
等瓣相似
当两个分子片段等瓣相似时,它们前沿轨道的数量、对称性、能量、形状以及其中的电子数是相似的。1
我们可以就用杂化轨道理论推导(中间的电子相当于非键)2:

不要把等瓣相似和开头的作差法混为一谈,虽然二者不少时候都能得到相同结果(尝试:Cr(CO)5、Fe(CO)5)。简化思考的方法——考虑电子数(作差)、可成键轨道数3(一般六个d2sp3)。
我们可以在两端增减电子4:
同样,可以将等瓣相似拓展到四边形配位,但相应的d电子数要加2(一个成键轨道不参与杂化,变为非键)

更多——三角双锥、四面体……)

特别注意:(下面的非键轨道只写d轨道)

我们把一个个片段全部等效成CH3(也就是H)、CH2、CH、C,也可以再用等电子原理推广成P、S等其他原子找熟面孔,接下来的推断我相信没有人不会。
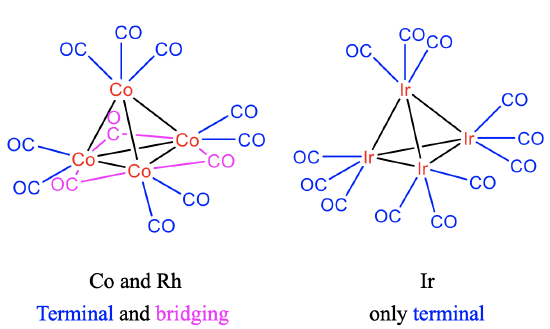
但等瓣相似也不是绝对的,尤其是针对第一过渡系原子的多聚物,常有意想不到的桥破坏对称性(其实成不成桥对18电子规则等没有影响)

例:P5-——Cp-
例:Ph3PAu——CH3——H(自己画画轨道)

Co(CO)4(AuPPh3)等不用多说,甚至有Ti(CO)6(AuPEt3)-(Ti七配位)
金属-金属键
同样可以认为是等瓣相似的结果(可惜没有δ键,某人朝思暮想的碳碳四键并不存在)
画出MO图,发现——Re2Cl8n-中Re-Re五重键可能不?No,那是因为四个配体与一个形成δ键的轨道作用从而使其能量发生改变5(这也是为啥大多数“5重键”物种配位数极低)正因如此,四重键才是强制重叠的(配体方向的轨道因为与配体作用而不能再成δ键)。
四重键与三重键(特别是去除δ*的电子)键长没啥区别——1.键级上升,有缩短趋势;2.库伦排斥上升,有变长趋势;3.有效核电荷上升,d轨道收缩,π键(δ太弱不考虑)成键变弱。
五重键——低配位数(对d轨道能量影响较少不妨碍成δ键);大(动力学保护)




