固体电解质
阳离子型
$\ce{Ag2HgI4}$:I 一直十分规则,Ag、Hg 分布在 Td(有的地方没有):低温——规则;高温——随机分布;而 Td 远多于 Ag(类似的有$\ce{AgI}$、$\ce{RbAg4I5}$):

β-氧化铝类——框架+充满空隙的结构:$\ce{Al2O3}$+缺陷 NaCl
阴离子型
主要依靠阴离子在空隙迁移导电,注意空隙太多形成簇状结构会降低导电能力
掺杂低价阳离子:$\ce{ZrO2}$掺入 Y、Ca。应用:氧分压传感器($p\ce{O2}$高的地方氧化,低的地方还原出$\ce{O2}$):

离子电子混合型
既有离子又有电子导电。例:Oh 位缺陷的钙钛矿型($\ce{La_{1-x}Sr_{x}CoO_{3-x}}$)。应用:固体氧化物燃料电池。
过渡金属一氧化物
多为 NaCl 型(向右演变到 ZnS),不少为非计量化合物,以$\ce{Fe_{1-x}O}$为例,注意$\ce{Fe^{3+}}$新填入的 Td 空隙与消失后$\ce{Fe^{2+}}$的 Oh 空隙的位置关系(也是 NaCl→ZnS):

甚至看似化学式正常的(如 TiO)也会出现 Schottky 空隙而脱离理想状态。
导电性:从左到右:金属性导体 → 半导体(d 轨道收缩,互相作用变弱难以形成能带)
靠右的半导氧化物导电是跳跃机理,即依靠载流子(电子 or 空穴)移动而非简单的能带。相同地,温度上升而半导体导电性也上升;$\ce{O2}$下用$\ce{Li2O}$掺入 NiO 增长导电性(联想 N、P 半导体)。
靠左的导体氧化物——能带分析:

磁性质:反铁磁性(超交换):Mn→Ni 逐渐加强(d 收缩,与 O 的 p 重叠更好)
高等氧化物和复合氧化物
$\ce{A2O3}$型
(CN 依次升高):B(三角形)→ Al → Sc(缺陷萤石$\ce{Sc4O6□_2}$)→Y(缺陷) → La
刚玉:Al、Ti、V、Rh、Fe、Ga 等
O:ABABAB;Al:$\ce{C1C2C3C1C2C3}$(每种只填 2/3 八面体空隙——六边形网)
总:$\ce{AC1BC2AC3BC1AC2BC3}$:

启示:两套不同长度的循环叠加——刚玉、方解石……
不少宝石也是这种结构
$\ce{La2O3}$:

$\ce{Sc2O3}$:缺陷萤石

三氧化铼
$\ce{CaTiO3}$的魔改,Oh 共享所有顶点:$\ce{RuO3,UO3,WO3}$(畸变,扭曲)
$\ce{RuO3}$为亮红色有光泽固体,导电性类似于金属 Cu——能带分析:

$\ce{AB2X4}$
尖晶石:
通式为$\ce{AB2X4}$或$\ce{A3X4}$(过渡金属氧化物)
价态搭配:**(II)+2(III)**或(IV)+2(II),常式:$\ce{A[B2]X4}$,反式:$\ce{B[AB]X4}$
占有因子:Td 上 B 占总 B 的分数:常式——0;反式——0.5
都为 d0 时,静电因素选择一般常式尖晶石(即(II)→Td,(III)→Oh)
存在 CFSE 时,比较哪种高自旋(O→ 弱场)在 Oh 的配位场稳定化能大(Td 很弱),一般有一个$\ce{d^5}$(无稳定)——无法解释?才考虑采取低自旋($\ce{Co3O4}$中 Co(III)为 d6 低自旋)

AFe2O4 可能被归入铁氧体——RT>J→ 顺磁性;RT<J→ 铁磁性或反铁磁性。
常可用作颜料:$\ce{CoAl2O4}$(钴蓝,常式);$\ce{CoCr2O4}$(绿色,常式);$\ce{CuCr2O4}$(黑色,常式)……
$\ce{K2NiF4}$:马上出现
钙钛矿
一般是碱土金属离子(较大)占据 12 配位空隙。
价态减半——$\ce{NaFeF3}$;阴阳交换——$\ce{SrNCo3}$;缺失——$\ce{ReO3}$。
容易形成固溶体和非计量化合物。
铁电性:整体的,永久的电极化作用——结构畸变。例子:$\ce{BaTiO3}$:

在外电场下,这些偶极子可以定向排布,撤去电场后依然存在(Tc 以下)——做电容
压电性:收到外部压力而产生电场——也和位移有关
类似结构——$\ce{K2NiF4}$(不是尖晶石结构)→ 每个片层之间位移(0.5,0.5):

如果多个片层为一个集合移动——Ruddlesden-Popper 相:$\ce{A3B2X7}$和$\ce{A4B3X10}$——通式:$\ce{AX + nABX3}$

联想——Wadsley 缺陷的逆向操作
巨磁阻:磁阻效应——接近 or 略高于 Curie 温度时在外加磁场中电阻显著降低:

如$\ce{Ln_{1-x}Ca_{x}MnO3}$——巨磁阻锰盐:$\ce{CaTiO3}$结构。低温金属性、铁磁性:双交换——Mn(III)和 Mn(IV)通过 O 交换;高温绝缘性、顺磁性——电子被特定位点捕获(电荷有序);外加磁场——有序 → 电子离域。
高温超导体
以下所有化学式都是理想情况——超导多为非计量化合物
这里讨论高温铜酸盐型超导体
$\ce{La_{2-x}Ba_{x}CuO4}$类:$\ce{K2NiF4}$型:J-T 拉长了 Cu 所在的 Oh。扩展——(Pn=VA 元素)。可以发现J-T 拉长的 Cu 的轴向部位很容易被换成其他元素或不与 Cu 配位,例:$\ce{Nd2CuO4}$中 Oh→ 立方体空隙(Nd)+正方形空隙(Cu)


YBCO(也叫“123”)型:$\ce{YBa2Cu3O7}$
晶胞(四方锥成层,四边形成链):Y——8 配位;Ba——10 配位。层状视角(在处理衍生物时十分有用:CuO——BaO——$\ce{CuO2}$——Y——$\ce{CuO2}$——BaO)

可以认为是 Cu(II)和 Cu(III)的混合,也可以认为存在部分充满的能带——空穴浓度=Cu(III)
衍生结构:$\ce{Tl2Ba2Ca2Cu3O10}$(TlO——TlO——BaO——$\ce{CuO2}$——Ca——$\ce{CuO2}$——Ca——$\ce{CuO2}$——BaO),品味以下结构:更多



其他结构:
| 化合物 | 结构 |
|---|---|
| $\ce{YBa2Cu3O7}$ | 已经介绍(CaTiO3 变体) |
| $\ce{Tl2Ba3Ca4Cu4O12}$ | YBCO 变体 |
| $\ce{MgB2}$ |  |
| $\ce{LiTi2O4}$ | 尖晶石 |
| $\ce{Nb3Ge,Nb3Sn}$ | A15 堆积 |
| $\ce{K_{0.4}Na_{0.6}BiO3}$ | 钙钛矿 |
| $\ce{K3C60}$ | $\ce{C60}$ ccp;K 填充所有 Td 和 Oh |
| $\ce{Pb[Mo6S8]}$ | 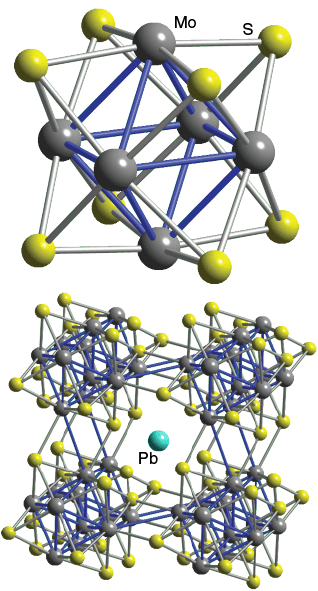 |
| NbPS(P-P 有键) |  |
| $\ce{LaFeAs(O,F)_{1-x}}$ |  注意层之间的对齐 注意层之间的对齐 |
| $\ce{M_{2-x}B2O_{7-x}}$(烧绿石) | 缺陷萤石,自旋冰 |
(M:Cs、Ca、Cd;B:重 d 金属)
可充电电池:
判断方向 →放电后过渡金属氧化态降低
LiCoO2——$\ce{[CoO_{6\times1/3}]}$层+$\ce{Li+}$嵌入其中 → 结构不易被破坏,可逆充电
为何经常使用 3d 金属和 Li——轻(氧化态可变的最轻金属)→ 比能量大
LiMn2O4——尖晶石结构
LiFePO4——橄榄石结构(Fe、Li→Oh;P→Td)
上面三个放电时得到一个电子和 Li+
另一边——LiC6:放电时失去电子,出 6C
$$ \ce{LiCoO2 + 6C <–>[{charge}][{discharge}] LiC6 + CoO2} $$
氧化物玻璃
玻璃:粘度很高的非晶态陶瓷
玻璃通过熔体冷却形成(动力学产物):1.冷却速率比结晶快得多(不容易结晶:硅酸盐、磷酸盐、硼酸盐等);2.较强的 Si-O 让玻璃动力学稳定——无法形成晶体。

Zachariasen 规则:共享顶点(而非棱或面)有利于玻璃生成(有序性更低)
加工:高温不方便,加入改性剂($\ce{Na2O}$、CaO):破坏 S-O-Si 结构,形成端位氧
类似玻璃:$\ce{B2O3、GeO2、P2O5}$等(不少硼酸盐、磷酸盐玻璃溶于水),也有硫、氟的
智能玻璃:电致变色:
$$ \begin{align*}\ce{WO3(\text{无色}) +xLi+ +xe- <–> Li_xWO3(\text{深蓝色})} \\ \ce{HxIrO2(\text{无色}) <–> IrO2(\text{深蓝色}) + xH+ + xe-}\end{align*} $$
光致变色:AgCl→ 小簇的 Ag(太阳眼镜)
自洁玻璃:金属氧化物涂层作为分解有机污垢的光催化剂
氮化物、氟化物、混合阴离子相
氮化物制备:$\ce{NaN3}$(出 Na 单质),直接与$\ce{N2}$反应(IIA 和 Li),氧化物的氨解(出$\ce{H2}$O,小心还原副反应)——氮化物一般价态较低(否则自身氧化还原)
$\ce{Si3N4}$($\ce{[SiN4]}$相连)N——三配位;$\ce{AMN2}$($\ce{SrZrN2}$)——$\ce{LiCoO2}$型
氧化物-氮化物:颜料、光催化剂——例:$\ce{CaTaO2N}$
氟化物和其他卤化物:氟化物的固态化学与氧化物类似(半径):
$\ce{FeF2、PdF2}$——金红石(特别多);AgF——岩盐;$\ce{NbF3}$——$\ce{ReO3}$;$\ce{KMnF3}$——钙钛矿;$\ce{K3Co2F7}$——Ruddlesden-Popper 相;$\ce{Li2NiF4}$——尖晶石(区分$\ce{K2NiF4}$)
复合氟化物:1.简单氟化物化合得到;2.沉淀出来($\ce{KMnF3}$);在 F2 中处理氧化物得到氧化物-氟化物——$\ce{Sr2CuO2F2}$是个超导体(前文已经介绍过了)
氟化物玻璃:$\ce{LiBF4}$中含有连在一起的 BF4?
其他卤化物:常见$\ce{CdI2}$(短)、$\ce{CdCl2}$型(长)
$\ce{CsNiCl3}$——共边$\ce{[NiCl6]}$链;钙钛矿结构、尖晶石结构
$\ce{CsNiF3}$注意区分——$\ce{K2NiF4}$
层状 MS2 及嵌层化合物
综述——16.11 节
层状化合物多为混合型晶体(层内____,层间范德华)。
合成:CVT(化学气相转移):

注意存在一个可逆反应(吸热):
$$ \ce{TaS2(s) +2I2(g) <=> TaI4(g) + 2S(g)} $$
CVT 规律:吸热反应——由高到低;放热反应——由低到高
$\ce{MS2}$分为两大类——层状(左侧)和孤立$\ce{S2^{2-}$(右侧,如$\ce{FeS2}$)
区分$\ce{CdI2}$型和$\ce{MoS2}$的相似性和区别
$\ce{TaS2}$:$\ce{CdI2}$型,填 Oh(AcB 口 AcB 口),层之间范德华力(色散力)连接

$\ce{MoS2}$:三棱柱空隙(AbA 口 CbC 口),上面两者都有很强的的层内共价作用($\ce{NbS2}$也如此),并且有多重层间的堆积方法
嵌入、插层:(发生氧化还原,使$\Delta G$有利)类似于碱金属嵌入石墨(e→ 导带),硫化物嵌入碱金属时 e→d 带,可以直接化合制备
类似于碱金属——插入$\ce{[CoCp2]}$,但$\ce{[FeCp2]}$不行(难氧化)
插层化合物属于离子-电子混合导体,通过化学方法或电化学方法让上述嵌入过程逆向进行
Chevrel 相
$\ce{A_{x}Mo6S8}$(Se、Te 也可以);$\ce{M6S8}$单元位于顶点,填隙原子位于体心。注意$\ce{M6S8}$单元的倾斜——有利于 M 和另一单元的 S 成键

性质——超导性;热电材料(用热发电,用电降温);高导电、低导热
热电材料:一般为多个单元组合而成——一种单元导电好(晶态),一种单元导热差(玻璃态、非晶)。
Bi2Te3:

$\ce{Ln_{x}CoAs3}$:($\ce{As4^{4-}}$)——ReO3 的扭曲(掺杂到体心体心)形式

注意每层只有三个正方形

也可认为是$\ce{ReO3}$朝向相同的棱上的 O(As)缩进去形成小四边形,因为原来有共用而缩进去后没有故每层仅 3 个$\ce{As4^{4-}}$。
框架结构
$\ce{MO4}$——3d 后期和低周期 p——Si、Al、P、Ga、Ge、As、B、Be、Li、Co、Zn
$\ce{MO6}$——密堆积而成(记住滑石的结构,OH→F)
略
金属氢化物
$\ce{MgH2}$——金红石结构
复合氢化物——$\ce{AlH4-、NiH6}$中随机缺失 H、NH2-(胺化物)
$$\ce{NaAlH4 -> Na3AlH6 + H2 ->NaH +Al +H2 -> Na +Al +H2}$$
$$\ce{Li3N +H2 -> LiH +LiNH2}$$
$\ce{LiBH4、Li3(NH2)2BH4、Li4(NH2)2(BH4)2}$
金属间化合物:$\ce{LaNi5H6、PdH0.6、ZrV2}$(Laves 相)、$\ce{Mg2NiH4}$($\ce{NiH4}$一团($\ce{NiH6}$中随机缺失 H),反萤石)

富勒化物
简单的富勒烯$\ce{C60}$分子为 fcc 堆积
$\ce{C60}$与碱金属蒸汽反应最高得$\ce{M6C60}$,$\ce{[C60]^{6-}}$为 bcc,$\ce{M+}$填充假 Td

有超导性的好家伙是$\ce{M3C60}$,$\ce{[C60]^{6-}}$为 fcc,$\ce{M+}$填充所有 Td 和 Oh
里面的 M 甚至可以被溶剂化——$\ce{Na2CsC60}$→$\ce{Na(NH3)4CsNaC60}$,显然被溶剂化的在 Oh
也可以混入一些分子($\ce{I2、P4}$……)
分子材料化学
一维金属
金属:平面四边形(d8)上下堆积:Pt(II)、Ir(I)
Peierls 畸变(等距排布不是能量最优状态):温度很低时没有一维金属是导体(热运动抹除畸变)

这样的话,长键的电子反键性增强,短键的成键性增强,导带中心引入了一个带隙,正好分开填满电子和未填电子的部分——形成了绝缘体或半导体
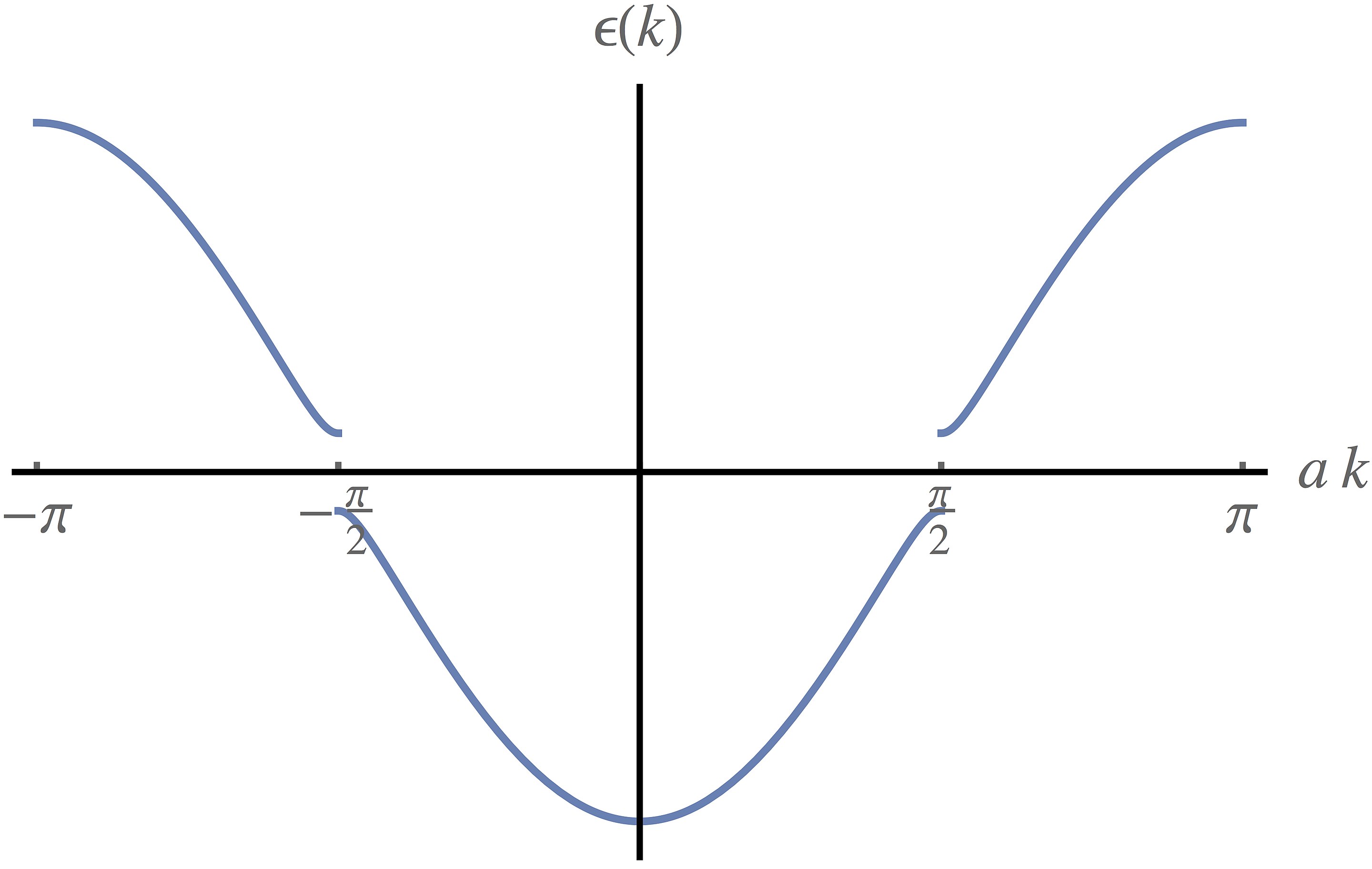
由于计量比的物质通常为半导体,需要氧化——$\ce{K2Pt(CN)4Br0.3·3H2O}$

此时 d 带导电(氧化使得满带 → 导带),然而由于 Peierls 畸变,低温下导电性急剧下降
非金属:$\ce{(SN)_{x}}$、有机聚合物 $\ce{[(CH)I0.25]_{n}}$(掺杂碘的聚乙炔)、荷移络合物(TTF-TCNQ、$\ce{TTF[Ni(dmit)2]}$):


分子磁体
TCNE 即$\ce{Fe(Cp^*)2}$,准确的是包含$\ce{[Fe(Cp^*)2]+,(C2(CN)4)-}$的链状
有桥键使自旋发生一些作用就行了
普鲁士蓝类似物
$\ce{Fe^{III}4[Fe_{II}_(CN)6]3}$
普鲁士蓝的结构可以将大离子引入立方空腔,治疗 Tl+和放射性 Cs+中毒
它也有铁磁性,类似物的强度更大(如$\ce{KV^{II}[Cr^{III}(CN)6]}$)。
无机液晶
性质介于液体和固体之间——至少在一个维度上具有有序性
基本元素的形状需为棒状或盘状

纳米离子
溶液法(均相)
加入稳定剂(表面活性分子)——防止小粒子溶解和再生长
Au 的纳米离子(深红色,用膦还原)——相转移催化剂(季铵盐)将$\ce{[AuCl4]-}$从水转移至甲苯,用硫醇做稳定剂(形成稳定配合物),$\ce{NaBH4}$还原:(稳定剂相对量越多纳米离子越小)

$\ce{Cd(CH3)2}$溶于膦氧化物和膦的混合物,加入 Se,得到 CdSe 纳米粒子
Ti 的醇盐水解得$\ce{TiO2}$纳米粒子
气相法
与溶液法相比,气相法的产物颗粒更大(不易加入稳定剂)
异相方法
纳米尺度反应容器——反向胶团合成
沉积——物理气相沉积、化学蒸汽沉积(分解和化合):

纳米结构和性质
一维材料
碳纳米管依靠一条**横截“线”**来描述卷曲方式:扶手椅 → 之字形 → 手性

可以是导体(椅型)也可以是半导体
二维
石墨烯——制备:1.Scotch®-tape 法;2.CVD:$\ce{CH4/H2}$分解沉积到金属上,用酸侵蚀金属
推广——层状化合物的剥离:$\ce{MS2}$、$\ce{V2O5}$
量子阱——没看懂
超晶格——几层 A 晶体-几层 B 晶体(如$\ce{BaTiO3}$-$\ce{SrTiO3}$)
三维
介孔材料——表面活性剂形成胶束 → 形成$\ce{SiO2}$层 → 加热除去表面活性剂:

光学性质
量子点(即半导体 n 变得比较小时能级离散)→ 同种材料改变尺寸即可在整个可见光区发光
